خلاصه
کاهش Fe ۲ O ۳ – Al ۲ O ۳ یکی از واکنش های مهم در استفاده از منابع ضایعات اکسید حاوی آهن است. Fe ۲ O ۳ -Al ۲ O ۳ در سیستم NaCl-KCl با الکترولیز نمک مذاب برای تهیه FeO/ Al2O3 الکترود اکسید شد . اثر محتوای Fe ۲ O ۳ بر فرآیند واکنش الکترودی اکسیداسیون مورد مطالعه قرار گرفت. نتایج نشان می دهد که تحت شرایط ۸۵۰ درجه سانتی گراد، ۲٫۳ ولت و الکتروداکسیداسیون به مدت ۴ ساعت، FeO/Al2O3 را می توان با کنترل محتوای Fe ۲ O ۳ به دست آورد . فرآیند اکسید زدایی به سه مرحله تقسیم شد: شارژ دو لایه الکتریکی، الکتروداکسیداسیون Fe ۲ O ۳ به Fe ۳ O ۴ و Fe ۳ O ۴ به FeO . با افزایش محتوای Fe ۲ O ۳ ، سرعت واکنش دی اکسیداسیون افزایش یافت و ذرات اکسید آهن کم ظرفیت به دست آمده توسط الکتروداکسیداسیون بزرگتر شدند. مکانیسم تأثیر Fe ۲ O ۳ بر فرآیند الکتروداکسیژناسیون با تجزیه و تحلیل نتایج تجربی تعیین شد. افزایش محتوای Fe ۲ O ۳ باعث افزایش غلظت مولکول های فعال در سیستم شد، در حالی که مقاومت الکترود اکسیداسیون را کاهش داد. مهاجرت ذرات فعال در کاتد نرمتر بود، که درصد اکسیژنزدایی مولکولهای فعال را افزایش داد و در نتیجه فرآیند واکنش دی اکسیداسیون را کوتاهتر کرد.
کلید واژه ها:
الکترولیز نمک مذاب ؛ سیستم Fe ۲ O ۳ -Al ۲ O ۳ – NaCl – KCl ; FeO/Al ۲ O ۳ ; مکانیسم تأثیر Fe ۲ O ۳
۱٫ معرفی
Fe ۲ O ۳ و Al ۲ O ۳ اجزای اصلی ضایعات جامد مانند گل قرمز، سرباره کوره بلند و سرباره کوره روی هستند [ ۱ ، ۲ ، ۳ ]. به منظور درمان این ضایعات جامد به عنوان منابع، محققان Fe ۲ O ۳ را از طریق آتش و روش های مرطوب به Fe 2 O 3 به FeO کم ظرفیت یا Fe ۳ O ۴ کاهش داده اند و در نهایت آهن فلزی [ ۴ ، ۵ ]، فروآلیاژها [ ۶ ]، مواد بستر جاده را به دست آورده اند. [ ۷ ] و مواد کامپوزیت Fe-FeAl ۲ O ۴ [ ۳ ، ۸ ، ۹ ]. بنابراین، واکنش کاهش سیستم Fe ۲ O ۳ – Al 2 O ۳ یک واکنش مهم برای تحقق بخشیدن به تصفیه منابع زباله جامد است و تحقیق در مورد واکنش سیستم از اهمیت زیادی برخوردار است.
در حال حاضر، واکنش کاهشی سیستم Fe ۲ O ۳ -Al ۲ O ۳ عمدتاً از طریق کاهش C [ ۱۰ ، ۱۱ ]، کاهش H2 [ ۱۲ ، ۱۳ ] ، کاهش CO [ ۱۴ ] و CO-CO2 [10، ۱۱ ] است. ۱۵ ] کاهش. این روش ها مصرف انرژی بالا و مشکلات انتشار CO ۲ دارند. در سالهای اخیر، روش الکترولیز نمک مذاب بهعنوان یک روش الکتروشیمیایی معمولی با مصرف انرژی کم و بدون انتشار CO2 مورد استفاده قرار گرفته است. این عمدتا شامل روش FFC [ ۱۶ ]، روش SOM [ ۱۷ ]، روش حرارتی کلسیم سیستم عامل [ ۱۸ ] و روش USTB [ ۱۹ ] است. از طریق الکترولیز نمک مذاب، فلزات با نقطه ذوب بالا، آلیاژهای فلزی، ترکیبات بین فلزی و سرامیک های کاربید در سیستم های نمک مذاب مانند CaCl ۲ -NaCl و NaCl-KCl [ ۲۰ ] تهیه شدند. تحقیقات الکتروداکسیداسیون روی سیستم Fe ۲ O ۳ -Al ۲ O ۳ عمدتاً بر روی تهیه FeAl و ترکیبات بین فلزی آن متمرکز شده است [ ۲۱ ، ۲۲ ، ۲۳ ، ۲۴ ] ، در حالی که محصول میانی FeO-Al2O3 کمتر دریافت کرده است. گزارش ها. واکنش کاهش Fe ۲ O ۳ -Al ۲ O ۳ به FeO-Al ۲ O ۳ یک فرآیند ضروری برای احیای Fe ۲ O ۳ -Al ۲ O ۳ به فلز Fe ، FeAl یا ترکیبات بین فلزی آن است. این یکی از پیوندهای کلیدی برای به دست آوردن مکانیسم کاهش Fe ۲ O ۳ – Al ۲ O ۳ است .
در اینجا، کاهش Fe ۲ O ۳ -Al ۲ O ۳ به FeO-Al ۲ O ۳ با استفاده از الکترولیز نمک مذاب در دمای ۸۵۰ درجه سانتی گراد در مذاب NaCl-KCl مورد مطالعه قرار گرفت. ریزساختار و ترکیب فازی محصولات بدون اکسیژن با استفاده از SEM و XRD مورد بررسی قرار گرفت. با بررسی تغییرات در ترکیب و ساختار کاتد در طول فرآیند الکترولیز، قانون تأثیر محتوای Fe ۲ O ۳ بر فرآیند الکترولیز و مسیر الکتروسنتز FeO-Al ۲ O ۳ در نمک مذاب نیز مورد مطالعه قرار گرفت.
۲٫ تجربی
مواد اولیه در این آزمایش عبارتند از: Al ۲ O ۳ خالص (Macklin Group Co., Ltd., Shanghai, China, Analytical Reagent) و Fe ۲ O ۳ (Sinopharm Group Co., Ltd., Shanghai, China, Analytical Reagent) ) پودرها به عنوان پیش سازهای کاتد استفاده شد. ابتدا مقادیر Al ۲ O ۳ و Fe ۲ O ۳ با توجه به نسبت جرمی جدول ۱ به مدت ۶ ساعت در اتانول آسیاب شدند . سپس دوغاب به مدت ۴ ساعت در خلاء خشک شد و مخلوط پودر به گلوله های استوانه ای (۱۰×۳×۱mm3) تحت فشار تک محوری ۸ مگاپاسکال فشرده شد . گلوله ها در دمای ۸۰۰ درجه سانتیگراد به مدت ۴ ساعت تحت جریان آرگون زینتر شدند تا گلوله های کاتدی بدست آید. سپس، گلوله های کاتد به یک سیم فولادی ضد زنگ ۳۰۴ برای مونتاژ کاتد متصل شدند. یک ورق گرافیت با چگالی بالا (۱۰۰ × ۱۵ × ۵ میلی متر ۳ ) به عنوان آند عمل می کند. مخلوط یوتکتیک NaCl-KCl (NaCl/KCl = 50.6:49.4 mol %, Sinopharm Group Co., Ltd., Shanghai, China, Analytical reagent) به عنوان الکترولیت استفاده شد که در یک بوته گرافیتی بسته بندی شد و در دمای ۳۰۰ آبگیری شد. درجه سانتی گراد به مدت ۲۴ ساعت بوته گرافیتی، پر از نمک مخلوط شده، به کف کوره لوله وارد شد. سپس کوره مهر و موم شد و گاز آرگون با خلوص فوق العاده بالا به داخل راکتور ریخته شد تا یک جو محافظ ایجاد کند. دمای کوره تحت گردش مداوم آرگون به ۸۵۰ درجه سانتیگراد افزایش یافت. سپس، یک ورقه گرافیتی تازه و کاتد در مذاب پایین آورده شد. الکترولیز در ولتاژ ۲٫۳ ولت به مدت ۴ ساعت انجام شد. پس از الکترولیز، نمونه ها چندین بار با آب مقطر شسته شدند تا نمک چسبنده جدا شود و به مدت ۱۲ ساعت در آب مقطر غوطه ور شد و سپس در دمای ۱۵۰ درجه سانتیگراد به مدت ۰٫۵ ساعت خشک شد. تصویر شماتیک اکسید زدایی الکتروشیمیایی در شکل ۱ نشان داده شده است .
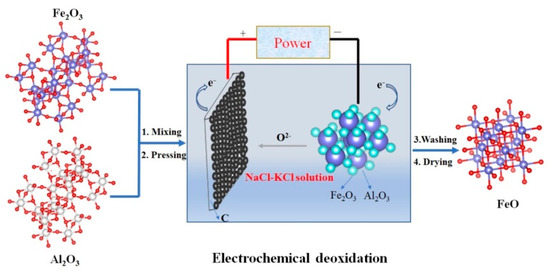
شکل ۱٫ تصویر شماتیک استراتژی اکسیدزدایی الکتروشیمیایی Fe ۲ O ۳ / Al ۲ O ۳ .
جدول ۱٫ شرایط آزمایشی خاص در اکسیداسیون الکتروشیمیایی.

ترکیب فاز با استفاده از پراش اشعه ایکس (XRD، XPert PRO MPD، PANalytical، Almelo، هلند) شناسایی شد. تجزیه و تحلیل ریزساختار و عنصر به ترتیب با SEM و EDS (GeminiSEM 300، Zeiss، آلمان) انجام شد.
۳٫ نتایج و بحث
۳٫۱٫ تجزیه و تحلیل ترمودینامیکی و کاهش الکتروشیمیایی Fe ۲ O ۳ – Al ۲ O ۳
هنگامی که انرژی می گیرد، Al ۲ O ۳ و Fe ۲ O ۳ در نمک مذاب تحت واکنش های الکترولیز زیر قرار می گیرند:
Al ۲ O ۳ (s) = 2Al(s) + 2/3O ۲ (g)
Fe ۲ O ۳ (s) = 2/3Fe ۳ O ۴ + ۱/۶O ۲ (g)
Fe ۳ O ۴ (s) = 3FeO + 1/2O ۲ (g)
FeO(ها) = Fe + 1/2O ۲ (گرم)
انرژی آزاد گیبس استاندارد واکنش احتمالی Fe ۲ O ۳ و Al ۲ O ۳ در سیستم نمک مذاب در دماهای مختلف با استفاده از FactSage7.3 قابل محاسبه است. ولتاژ تجزیه نظری استاندارد E Θ با فرمول (۵) محاسبه شد.
Δ G Θ = – n F E Θ
که در آن Δ G Θ انرژی آزاد استاندارد گیبس است (kJ·mol -۱ ). E Θ ولتاژ تجزیه نظری در حالت استاندارد (V) است. F ثابت فارادی است (۹۶۴۸۵ C·mol -۱ ). و n تعداد الکترون های بدست آمده یا از دست رفته در معادله واکنش است.
شکل ۲ منحنی تغییر E Θ با T را در واکنش های مختلف نشان می دهد. با افزایش دمای واکنش، E Θ مثبت تر می شود. در دمای ۶۰۰ تا ۱۱۰۰ درجه سانتیگراد، ترتیب واکنش بین (۱) ~ (۴) (۲) > (3) > (4) > (1) است.
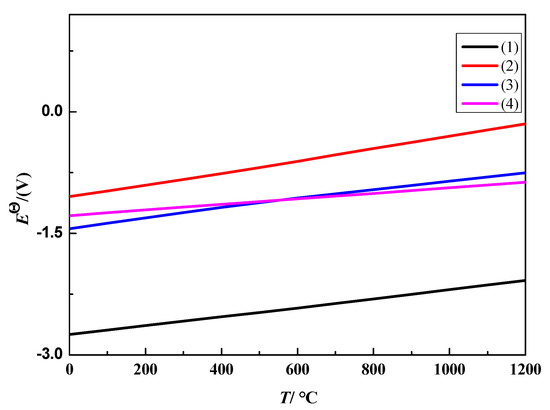
شکل ۲٫ E Θ – نمودار T از واکنش های الکتروشیمیایی که ممکن است در فرآیند الکتروداکسیداسیون رخ دهد.
۳٫۲٫ تاثیر بر میزان اکسیژن زدایی
شکل ۳ الگوی XRD الکترولیز را در شرایط آزمایشی در جدول ۱ نشان می دهد . محتوای Fe ۲ O ۳ در نمونه های S ۱ ~ S ۴ به ترتیب افزایش یافت. S ۱ و S ۲ به Fe ۳ O ۴ ، FeO و Al ۲ O ۳ الکترولیز می شوند . S ۳ و S ۴ به FeO و Al ۲ O ۳ الکترولیز شدند . قلههای Fe ۳ O ۴ به تدریج از S ۱ به S ۴ تضعیف شدند ، قلههای FeO قویتر شدند و قلههای Al ۲ O ۳ به نوبه خود ضعیفتر شدند. این نتایج تجربی نشان میدهد که با افزایش محتوای Fe ۲ O ۳ ، تشکیل FeO آسانتر بود و به نظر میرسد Al ۲ O ۳ تا حدی کاهش مییابد. این تغییر FeO به دلیل افزایش Fe ۲ O ۳ در نمونه ها بود. درصد جرمی مولکولهای فعالشده Fe ۲ O ۳ را در سیستم افزایش داد که میتوانند در واکنش اکسیدزدایی الکتریکی شرکت کنند و در نتیجه سرعت واکنش اکسیدزدایی را افزایش داد. از آنجایی که شرایط میدان خارجی مانند دما و ولتاژ سیستم نمک مذاب تغییر نکرده بود، شار انتشار O2- در نمک مذاب NaCl-KCl بدون تغییر باقی ماند. با افزایش سرعت واکنش اکسیداسیون، O2- تولید شده توسط الکترولیز نمی تواند به موقع به آند تحویل داده شود و O2- بیشتری در نزدیکی کاتد انباشته می شود. این بخش از O ۲- با Na + و K + برای تولید Na ۲ O و K ۲ O واکنش داد و سپس با Al ۲ O ۳ برای تولید NaAlO ۲ و KAlO ۲ واکنش نشان داد . با حل شدن NaAlO2 و KAlO2 در نمک مذاب NaCl-KCl، این منجر به کاهش Al2O3 در کاتد شد. واکنش الکتروشیمیایی Fe ۲ O ۳ شامل دو مرحله بود. اولین واکنش به Fe ۳ O ۴ الکترولیز شد و سپس واکنش Fe ۳ O ۴ به FeO الکترولیز شد. این نتیجه گیری با گزارش های ادبیات [ ۲۱ ،] مطابقت دارد .۲۵ ، ۲۶ ].
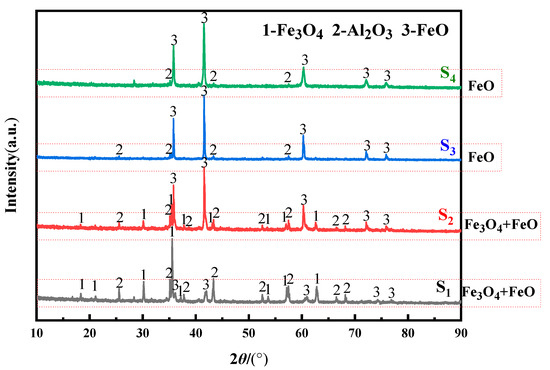
شکل ۳٫ الگوهای XRD محصولات الکترولیز اکسید با نسبت های مختلف مواد خام.
شکل ۴ منحنی های تغییر جریان با زمان را در فرآیند اکسید زدایی الکتریکی S ۱ ~ S ۴ نشان می دهد. جریان مقدار الکتریسیته در واحد سطح است و نشان دهنده میزان اکسید زدایی الکتریکی در طی فرآیند اکسید زدایی الکتریکی است. فرآیند واکنش الکتروداکسیژناسیون Fe ۲ O ۳ / Al ۲ O ۳ به سه مرحله تقسیم شد: A، B و C. مرحله A فرآیند شارژ لایه دوگانه الکتریکی بود. جریان با گذشت زمان افزایش یافت و به حداکثر جریان رسید. در این زمان، مقاومت کمترین، نرخ اکسیدزدایی الکتریکی بالاترین، و جریان بزرگترین بود، و فعال ترین ذرات تولید شد. هنگامی که جریان به حداکثر جریان رسید، این نشان داد که لایه دوگانه الکتریکی به طور کامل شارژ شده است و واکنش اکسیدزدایی الکتریکی در ۳PI شروع به رخ دادن کرد. مرحله B فرآیند واکنش الکتروداکسیداسیون Fe ۲ O ۳ بود. همراه با نتایج شکل ۳ ، این مرحله باید واکنش الکتروداکسیداسیون Fe ۲ O ۳ به Fe ۳ O ۴ باشد (یعنی واکنش (۲))، و جریان با زمان واکنش کاهش می یابد. همانطور که اکسیداسیون الکتریکی Fe ۲ O ۳ به Fe ۳ O ۴ پیشرفت کرد، نمک مذاب از لایه محصول عبور کرد و ۳PI های جدید در محصول واکنش / ماده واکنش نداده تشکیل داد. ذرات فعال Fe ۳ + الکترون ها را در ۳PI به دست آوردند، و O2- در نمک مذاب NaCl-KCl منتشر شد و به آند مهاجرت کردند. مانند الکتروداکسیژناسیون Fe ۲ O ۳ به واکنش Fe ۳ O ۴ فوق الذکر ، تشکیل ۳PIs، انتقال O ۲- و سایر فرآیندهای واکنش مقاومت سیستم را افزایش می دهد و جریان با زمان کاهش می یابد. مرحله C فرآیند اکسیژن زدایی Fe ۲ O ۳ به FeO بود (یعنی واکنش های (۲) و (۳)). جریان با زمان واکنش کاهش یافت و کمتر از مرحله B بود. در مقایسه با مرحله B، مرحله C واکنش الکتروداکسیداسیون Fe ۳ O 4 به FeO (یعنی واکنش (۳)) و مقاومت را افزایش داد . سیستم بیشتر افزایش یافت، به این معنی که جریان با گذشت زمان کاهش یافت و کمتر از پدیده جریان مرحله B بود.
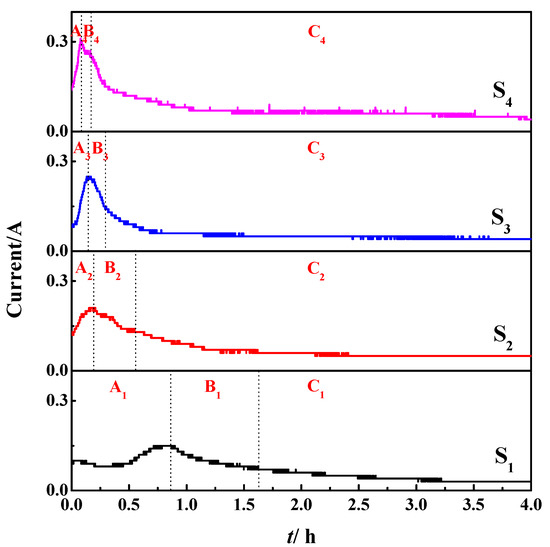
شکل ۴٫ منحنی های جریان-زمان در حین الکترولیز S ۱ (mFe ۲ O ۳ / mAl ۲ O ۳ = ۱: ۱)، S ۲ (mFe ۲ O ۳ / mAl ۲ O ۳ = ۳: ۲)، S ۳ ( mFe ۲ O ۳ / mAl ۲ O ۳ = ۲: ۱)، و S ۴ (mFe ۲ O ۳ / mAl ۲ O ۳ = ۴: ۱) در ۲٫۳ V، ۸۵۰ درجه سانتیگراد و ۴ ساعت.
برای منحنی های I – t مربوط به S ۱ ، S ۲ ، S ۳ و S ۴ ، مشخص شد که مرحله A، مرحله B و مرحله C تغییرات خاصی دارند. در مرحله A، شیب منحنی های مربوطه برای S ۱ ~ S ۴ بزرگتر شد و زمان تکمیل فرآیند شارژ دو لایه الکتریکی ۰٫۷۸ ساعت، ۰٫۱۹ ساعت، ۰٫۱۶ ساعت و ۰٫۰۹ ساعت بود که کاهش تدریجی را نشان می دهد. و حداکثر جریان ۰٫۱۵A، ۰٫۲۰ A، ۰٫۲۴ A و ۰٫۳ A بود که افزایش تدریجی را نشان می دهد. به همین ترتیب، در مرحله B و مرحله C، شیب منحنی های مربوطه S ۱ ~ S ۴ بزرگتر شد و زمان لازم برای تکمیل واکنش این مرحله کوتاهتر شد. این نتایج نشان می دهد که میزان اکسید زدایی الکتریکی Fe ۲ O ۳ / Al ۲ O ۳ با افزایش محتوای Fe ۲ O ۳ افزایش می یابد . این باعث پیشرفت واکنش اکسید زدایی الکتریکی شد و زمان لازم برای تکمیل فرآیند واکنش مربوطه را کوتاه کرد. دو دلیل برای پدیده فوق وجود دارد. یکی این است که افزایش Fe ۲ O ۳ باعث افزایش تعداد مولکول های فعال شده Fe ۲ O ۳ در سیستم می شود که می توانند در واکنش الکتروداکسیژناسیون شرکت کنند. این باعث افزایش غلظت اولیه مولکولهای فعال شده در واکنش الکتروداکسیژناسیون Fe ۲ O ۳ شد و در نتیجه سرعت واکنش اکسیژنزدایی را افزایش داد. دوم این است که Al ۲ O ۳ یک اکسید با مقاومت بالا و عایق الکتریکی قوی است [ ۲۷ ]. Al ۲ O ۳ در نمونه S ۱ ~ S ۴ به ترتیب کاهش یافت. این بدان معنی است که مقاومت سیستم دی اکسید کننده به ترتیب کاهش یافته و مقاومت الکترون های آزاد را به ۳PI کاهش می دهد. به نوبه خود، سرعت واکنش اکسیژن زدایی افزایش یافت. اثر محتوای Fe ۲ O ۳ بر میزان اکسیداسیون با نتایج XRD در شکل ۳ مطابقت دارد .
۳٫۳٫ تأثیر بر ساختار سازمانی
شکل ۵ ، شکل ۶ و شکل ۷ مورفولوژی SEM، اسکن نقطه ای و اسکن سطح محصول الکتروداکسیداسیون Fe ۲ O ۳ / Al ۲ O ۳ را نشان می دهد. مشاهده می شود که S ۱ و S ۲ Fe ۳ O ۴ ، FeO و Al ۲ O ۳ هستند . S ۳ و S ۴ FeO و Al ۲ O ۳ هستند . Al ۲ O ۳ ذرات بزرگ منظم و صاف است و ذرات Fe ۳ O ۴ و FeO کوچکتر هستند. Fe ۳ O ۴ و FeO به Al ۲ O ۳ چسبیدند ، هسته شدند و رشد کردند. با افزایش محتوای Fe ۲ O ۳ ، Al ۲ O ۳ در معرض کاهش یافت و اکسیدهای آهن کم ظرفیت اطراف سطح ذرات Al ۲ O ۳ افزایش یافت. ذرات اکسید آهن کم ظرفیت به تدریج به چند وجهی بزرگتر و زاویه دار تبدیل شدند. تحت شرایط الکترولیز یکسان، با افزایش محتوای Fe ۲ O ۳ ، مقدار کم Fe ۲ O ۳ می تواند Fe ۳ O ۴ و FeO را تولید کند، در حالی که محتوای بالا فقط FeO را تولید می کند. این نشان می دهد که افزایش محتوای Fe ۲ O ۳ باعث افزایش سرعت واکنش اکسیداسیون شد. ذرات بزرگ، صاف و با مقاومت بالا Al ۲ O ۳ مانع مهاجرت ذرات فعال در فرآیند اکسید زدایی شدند. ذرات فعال مورد نیاز برای دور زدن Al ۲ O ۳ و انجام واکنش اکسید زدایی الکتریکی در Fe ۲ O ۳ در اطراف Al ۲ O ۳ هستند . بنابراین، ذرات Fe ۳ O ۴ و FeO در اطراف Al ۲ O ۳ رشد کردند و کاهش محتوای Al ۲ O ۳ نیز برای افزایش سرعت واکنش اکسیداسیون مفید بود. با افزایش سرعت الکتروداکسیداسیون، فرآیند الکتروداکسیداسیون Fe ۲ O ۳ به Fe ۳ O ۴ (واکنش (۲)) کوتاه شد و واکنش Fe ۳ O ۴الکترود اکسیداسیون به FeO (واکنش (۳)) سریعتر بود. در همان زمان، هسته کریستال FeO زمان بیشتری برای رشد داشت و در نهایت ذرات FeO بزرگتر به دست آمد.

شکل ۵٫ تصاویر SEM S ۱ (mFe ۲ O ۳ / mAl ۲ O ۳ = ۱: ۱) در ( a )، S ۲ (mFe ۲ O ۳ / mAl ۲ O ۳ = ۳: ۲) در ( b ) ، S ۳ (mFe ۲ O ۳ / mAl ۲ O ۳ = ۲: ۱) در ( c ) و S ۴ (mFe ۲ O ۳ / mAl ۲ O ۳ = ۴: ۱) در ( d ) در ۲٫۳ V ، ۸۵۰ درجه سانتی گراد و ۴ ساعت
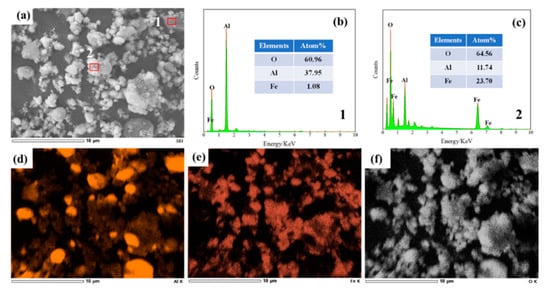
شکل ۶٫ تصاویر SEM S ۱ (mFe ۲ O ۳ / mAl ۲ O ۳ = ۱: ۱) در ( a )، طیف نقطه ای برای ۱ اینچ ( b )، طیف نقطه ای برای ۲ اینچ ( c ) و EDS طیف Fe در ( d )، Al در ( e ) و O در ( f ) در ۲٫۳ V، ۸۵۰ درجه سانتیگراد و ۴ ساعت.
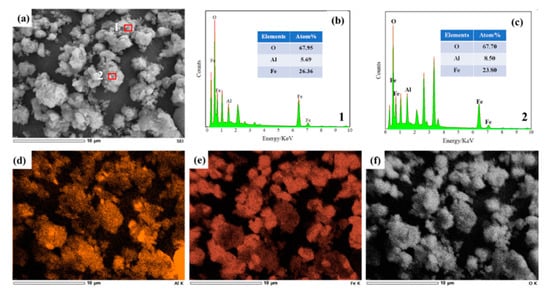
شکل ۷٫ تصاویر SEM S4 ( mFe ۲ O ۳ / mAl ۲ O ۳ = ۴: ۱) در ( a )، طیف نقطه ای برای ۱ اینچ ( b )، طیف نقطه ای برای ۲ اینچ ( c ) و EDS طیف Fe در ( d )، Al در ( e ) و O در ( f ) در ۲٫۳ V، ۸۵۰ درجه سانتیگراد و ۴ ساعت.
۳٫۴٫ مکانیسم اثر
از نتایج XRD و SEM بالا، می توان دریافت که افزایش محتوای Fe ۲ O ۳ باعث افزایش سرعت واکنش اکسیداسیون FeO / Al ۲ O ۳ تهیه شده توسط Fe ۲ O ۳ / Al ۲ O ۳ الکترو دی اکسیداسیون شد. به منظور شفاف سازی بیشتر فرآیند واکنش اکسیژن زدایی، آنالیز XRD بر روی محصولات اکسیژن زدایی S2 در ۰٫۵ ساعت، ۱ ساعت و ۴ ساعت انجام شد ، همانطور که در شکل ۸ نشان داده شده است . هنگامی که واکنش به ۰٫۵ ساعت رسید، رنگ نمونه از قرمز به سیاه تغییر کرد ( شکل ۹ )، و محصول اکسید زدایی Fe ۳ O ۴ و Al ۲ O ۳ بود . هنگامی که واکنش به ۱ ساعت رسید، محصول دی اکسیداسیون Fe ۳ O ۴ ، FeO و Al ۲ O ۳ بود . هنگامی که واکنش به ۴ ساعت رسید، رنگ نمونه از سیاه به سبز تیره تغییر کرد ( شکل ۹ )، و محصول دی اکسید شده نیز Fe ۳ O ۴ ، FeO و Al ۲ O ۳ بود .
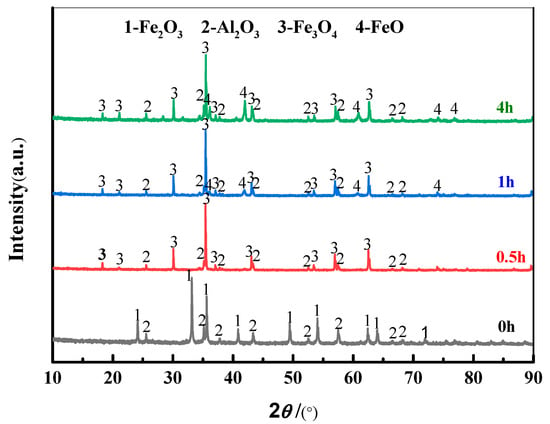
شکل ۸٫ الگوهای XRD S ۲ (mFe ۲ O ۳ / mAl ۲ O ۳ = ۳: ۲، در ۲٫۳ V، ۸۵۰ درجه سانتیگراد) در زمان های مختلف.
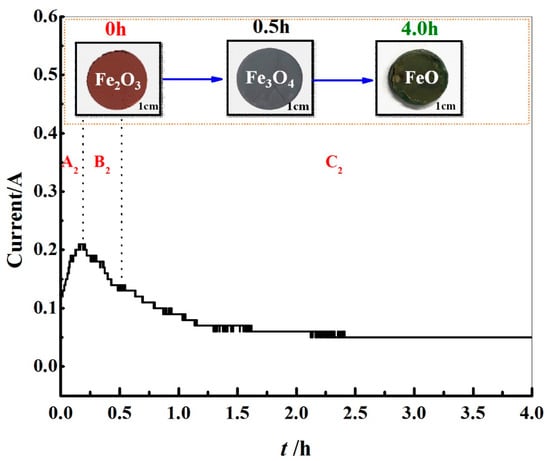
شکل ۹٫ منحنی های I – t الکترولیز S ۲ (mFe ۲ O ۳ / mAl ۲ O ۳ = ۳: ۲، در ۲٫۳ V، ۸۵۰ درجه سانتی گراد و ۴ ساعت).
با توجه به شکل ۸ و شکل ۹ ، می توان مشاهده کرد که واکنش از ۰ تا ۰٫۱۹ ساعت متعلق به مرحله A است که یک فرآیند شارژ دو لایه الکتریکی بود. ذرات فعال به سرعت در ۳PI جمع شدند و واکنش الکترواکسیژن زدایی Fe ۲ O ۳ با حداکثر سرعت واکنش آغاز شد. از ۰٫۱۹ تا ۰٫۷۵ ساعت به مرحله B تعلق داشت و واکنش (۲) Fe ۳ O ۴ را تولید کرد که با تشکیل ۳PI های جدید در محل اتصال Fe ۳ O ۴ / Fe ۲ O ۳ / نمک مذاب NaCl-KCl همراه بود. از ۰٫۷۵ تا ۴ ساعت به مرحله C تعلق داشت و واکنش (۳) FeO را تولید کرد که با تشکیل ۳PIهای جدید در محل اتصال نمک مذاب FeO/Fe3O4 /NaCl-KCl همراه بود . از شکل ۴ می توان دریافت که واکنش الکتروداکسیداسیون با محتویات مختلف Fe ۲ O ۳ شامل سه مرحله A، B و C است. با ترکیب نتایج شکل ۸ و شکل ۹ ، Fe ۲ O ۳ / Al ۲ O همانطور که در شکل ۱۰ نشان داده شده است، می توان مکانیسم واکنش الکتروداکسیداسیون را به دست آورد . با افزایش محتوای Fe ۲ O ۳ ، غلظت مولکول های فعال در سیستم افزایش یافت، مقاومت Al ۲ O ۳ در سیستم کاهش یافت و سرعت واکنش واکنش های (۲) و (۳) افزایش یافت. . این امر زمان تکمیل مراحل A، B و C را کوتاه کرد.
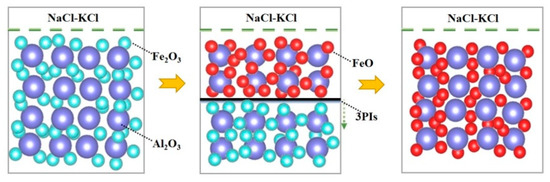
شکل ۱۰٫ تصویر شماتیک فرآیند الکتروشیمیایی در طی احیای الکتریکی Fe ۲ O ۳ / Al ۲ O ۳ .
۴٫ نتیجه گیری
در این مقاله، از الکترولیز نمک مذاب برای بررسی فرآیند واکنش کاهش الکترولیتی Fe ۲ O ۳ -Al ۲ O ۳ FeO-Al ۲ O ۳ در سیستم NaCl-KCl استفاده شد. تأثیر محتوای Fe ۲ O ۳ بر فرآیند الکترولیز مورد تجزیه و تحلیل قرار گرفت. هنگامی که شرایط الکترولیز ۸۵۰ درجه سانتیگراد، ۲٫۳ ولت و زمان واکنش ۴ ساعت بود، Fe ۲ O ۳ -Al ۲ O ۳ را می توان به Fe ۳ O ۴ ، FeO و Al ۲ O ۳ الکترولیز کرد . FeO-Al ۲ O ۳ را می توان با تنظیم محتوای Fe ۲ O ۳ به دست آورد . افزایش محتوای Fe ۲ O ۳ می تواند سرعت واکنش اکسید زدایی را افزایش داده و زمان کاهش Fe ۲ O ۳ را به Fe ۳ O ۴ و Fe ۳ O ۴ به FeO را کاهش دهد. محصول الکترولیز هسته ای شد و در اطراف Al ۲ O ۳ رشد کرد و در نهایت به چند وجهی زاویه ای تبدیل شد. با مطالعه فرآیند دینامیکی واکنش الکترو اکسیژن زدایی، مکانیسم واکنش الکتروداکسیژناسیون به دست آمد. این شامل شارژ دو لایه الکتریکی، اکسیژن زدایی Fe ۲ O ۳ برای تولید Fe ۳ O ۴ ، و Fe ۳ O ۴ برای تولید FeO بود که با تشکیل ۳PI های جدید، انتقال O ۲- و سایر واکنش ها همراه بود. اصل به دست آوردن FeO با تنظیم محتوای Fe ۲ O ۳ این بود که افزایش محتوای Fe ۲ O ۳ باعث افزایش غلظت مولکول های فعال در سیستم شد. علاوه بر این، مقاومت Al ۲ O ۳ را در سیستم کاهش داد. ذرات فعال به آرامی در کاتد مهاجرت کردند و سرعت واکنش واکنش های (۲) و (۳) را افزایش دادند. سرعت واکنش زمان واکنش شارژ دو لایه الکتریکی، تولید Fe ۳ O ۴ ، تولید FeO و سایر مراحل را کوتاه کرد. همانطور که همه می دانیم، علاوه بر محتوای Fe ۲ O ۳ ، دمای واکنش، زمان واکنش و ولتاژ همگی عواملی هستند که بر کاهش الکترولیتی Fe ۲ O ۳ -Al تأثیر می گذارند.۲ O ۳ به FeO-Al ۲ O ۳ . تحقیقات بعدی بر روی مکانیسم دمای واکنش، زمان واکنش و ولتاژ در فرآیند کاهش تمرکز خواهد کرد.