اکسیداسیون دوزینگ پمپ استنلس استیل SS304 SS316
با توجه به اکسید کنندگی بسیاری از اسیدها و مخصوصا کلر بهتر است از هد استیل استفاده نشود
هد جایگزین میتواند هر پلیمری باشد
حالت اکسیداسیون

در شیمی ، حالت اکسیداسیون (EO) نشانگر درجه اکسیداسیون یک اتم است که بخشی از یک ترکیب یا یک گونه شیمیایی دیگر (به عنوان مثال، یک یون ) است. به طور رسمی، این بار الکتریکی فرضی است که اتم در صورتی که تمام پیوندهای آن با عناصر مختلف ۱۰۰٪ یونی باشد، خواهد داشت.
EO با اعداد نشان داده می شود که می تواند مثبت، منفی یا صفر باشد. در برخی موارد، میانگین حالت اکسیداسیون یک عنصر کسری است، مانند ۳/۸+ برای آهن در مگنتیت (Fe 3 O 4 ). بالاترین EO شناخته شده +۸ برای تتراکسیدهای روتنیم ، زنون ، اسمیم ، ایریدیم ، هاسیوم و برخی ترکیبات پیچیده است ، پلوتونیوم در حالی که کمترین EO شناخته شده برای برخی از عناصر گروه کربن (عناصر گروه ۱۴ ) -۴ است.
بر اساس مقررات IUPAC ، نماد عنصر شیمیایی باید به صورت بالانویس نوشته شود و ابتدا عدد را نشان دهد و بعد از آن علامت را نشان دهد. به عنوان مثال Al 3+
اکسیداسیون زمانی اتفاق می افتد که یک عنصر یا ترکیب یک یا چند الکترون را از دست بدهد . به طور کلی، هنگامی که یک ماده اکسید می شود (الکترون ها را از دست می دهد)، ماده دیگری این الکترون ها را دریافت یا جذب می کند و خود را کاهش می دهد. این مکانیسم اساسی است که واکنشهای کاهش اکسیداسیون یا ردوکس را ترویج میکند.
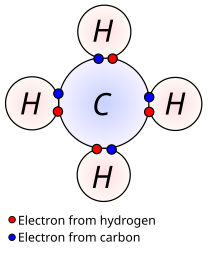
اطاعت کند تشکیل نمی دهند) تمایل دارد از قانون هشت یک اتم به منظور داشتن پیکربندی الکترونیکی برابر با گازهای نجیب ، که از نظر شیمیایی بسیار پایدار هستند (اتم های آنها پیوندهای شیمیایی تقریباً با هیچ کس، حتی با خودشان، . این قانون بر این باور است که یک اتم در سطح انرژی بیرونی ترین خود هشت الکترون دارد. در مورد هیدروژن ، تمایل به داشتن ۲ الکترون دارد که به آن پیکربندی الکترونیکی مشابه هلیم می دهد.
هنگامی که یک اتم A برای اطاعت از قانون هشت، برای مثال به ۳ الکترون نیاز دارد، اتم گفته شده تمایل به داشتن عدد اکسیداسیون ۳- دارد، زمانی که آن ۳ الکترون را به دست آورد. از طرف دیگر، وقتی یک اتم B دارای ۳ الکترون است که باید برای اتم A داده شود تا قانون اکتت را برآورده کند، آنگاه این اتم تمایل به داشتن عدد اکسیداسیون ۳+ دارد، زمانی که آن ۳ الکترون را رها کند. در این مثال میتوان نتیجه گرفت که اتمهای A و B میتوانند با هم متحد شوند و ترکیبی را تشکیل دهند و این بستگی به برهمکنش بین آنها دارد. قوانین اکتت و دوئت را می توان با به اشتراک گذاشتن الکترون ها (تشکیل ترکیبات کووالانسی ، به عنوان مثال در مولکول هایی مانند آب) یا با رها کردن و به دست آوردن الکترون (تشکیل ترکیبات یونی ، به عنوان مثال در بلورهای سدیم کلرید ) ارضا کرد.
عناصر شیمیایی به ۳ گروه بزرگ تقسیم می شوند که بر اساس نوع بار الکتریکی که می توانند هنگام شرکت در یک واکنش شیمیایی به دست آورند، طبقه بندی می شوند :
- فلزات .
- فلزات نه
- گازهای نجیب .
عناصر فلزی وجود دارند که بسته به شرایطی که در معرض آن قرار میگیرند، میتوانند به صورت فلزی یا غیرفلزی عمل کنند. این عناصر را نیمه فلزات یا متالوئیدها می نامند .
عناصر فلزی (که تمایل به اهدای الکترون دارند) هنگامی که ترکیباتی را تشکیل می دهند معمولاً حالت اکسیداسیون مثبت دارند. از طرف دیگر عناصر غیرفلزی و نیمه فلزی بسته به ترکیبی که تشکیل می دهند، می توانند حالت اکسیداسیون مثبت و منفی داشته باشند.
مثالها اکسیداسیون دوزینگ پمپ استنلس استیل SS304 SS316
- سدیم کلرید
۲Na 0 + Cl 0 2 → ۲Na 2Cl 1 + + 1-
گازهای تنها یک نوع عنصر، در این مورد کلر، به شکل دو اتمی وجود دارد.
سدیم ( Na ) با کلر (Cl) ترکیب می شود و کلرید سدیم تولید می کند. عدد اکسیداسیون هر دو عنصر ترکیب نشده ۰ (صفر) است، زیرا آنها از نظر الکتریکی متعادل هستند. عدد اکسیداسیون سدیم ترکیبی ۱+ است، زیرا یک الکترون از دست می دهد. عدد اکسیداسیون کلر ترکیبی ۱- است، زیرا الکترون اهدایی سدیم را می پذیرد.
- اکسید آلومینیوم
Al 0 + O 0 2 → Al 3 + + 2O 2-
اکسیژن ( O ) به شکل دو اتمی (گاز) وجود دارد.
آلومینیوم آلومینیوم (Al) با اکسیژن (O) ترکیب می شود و اکسید (Al 2 O 3 ) تولید می کند. عدد اکسیداسیون هر دو عنصر ترکیب نشده ۰ (صفر) است، زیرا آنها از نظر الکتریکی متعادل هستند. عدد اکسیداسیون آلومینیوم ترکیبی ۳+ است، زیرا سه الکترون تولید می کند. عدد اکسیداسیون اکسیژن ترکیبی ۲- است، زیرا حداکثر ۲ الکترون را می پذیرد.
الکترون هایی که توسط عناصر مختلف تسلیم شده و پذیرفته می شوند، مشکلی در بارهای الکتریکی ایجاد می کنند. به عنوان مثال، آلومینیوم سه الکترون می دهد و اکسیژن فقط دو الکترون می پذیرد، بنابراین یکی باقی می ماند. از این نتیجه میشود که حتی یک اتم اکسیژن در واکنش دخالت نمیکند ، بنابراین معادله را متعادل میکنیم، به طوری که تمام الکترونهای منتقلشده با ظرفیتهای هر عنصر پذیرنده منطبق هستند.
معادله متعادل به صورت زیر است:
۴Al 0 + 3O 0 2 → ۴Al 3+ + 6O 2- → ۲Al 3+ + 3O 2-
که با آن تعادل کامل به دست می آید به طوری که تمام الکترون های اضافی در آن قرار می گیرند. عناصر موجود در یک عنصر آزاد یا حالت پایه دارای عدد اکسیداسیون برابر با ۰ هستند.
- همه عناصر فلزی (که الکترون اهدا می کنند) معمولاً هنگام تشکیل ترکیبات حالت اکسیداسیون مثبت دارند.
- عناصر غیرفلزی و نیمه فلزی بسته به ترکیبی که تشکیل می دهند می توانند حالت اکسیداسیون مثبت و منفی داشته باشند.
- برای هر عنصر حداکثر حالت اکسیداسیون مربوط به عدد گروه است.
- کوچکترین حالت اکسیداسیون ممکن یک عنصر ۴- است و برخی از عناصر گروه ۴A آن را دارند.
- نافلزات یک حالت اکسیداسیون منفی دارند که برابر با عدد گروه منهای ۸ است.
- عناصر گروه ۱A و ۲A به ترتیب دارای حالت اکسیداسیون ۱+ و ۲+ هستند.
- هیدروژن به طور کلی با حالت اکسیداسیون ۱+ کار می کند، به جز زمانی که هیدریدهای فلزی را تشکیل می دهد که در آن حالت اکسیداسیون آن ۱- است.
- عدد اکسیداسیون O 2- است، وقتی پراکسید می شود ، جایی که ۲- است، و وقتی سوپراکسید تشکیل می دهد ، جایی که ۱- است.
- مجموع حالت های اکسیداسیون همه عناصر یک ترکیب برابر با بار خالص آن است.
قوانین حالت اکسیداسیون دوزینگ پمپ استنلس استیل SS304 SS316
- حالت اکسیداسیون همه عناصر در حالت آزاد، بدون ترکیب با سایر عناصر، صفر است (به عنوان مثال، Na, Cu, Mg, H 2 , O 2 , Cl 2 , N 2 ).
- حالت اکسیداسیون H 1+ است، به جز در هیدریدهای فلزی که ۱- است (به عنوان مثال، NaH، CaH 2 ).
- حالت اکسیداسیون O 2- است، به جز در پراکسیدها که در آن -۱ است، در سوپراکسیدها که ۱/۲- است و در فلوراید اکسیژن (OF 2 ) که ۲+ است.
- حالت اکسیداسیون عنصر فلزی یک ترکیب یونی مثبت است.
- در ترکیبات کووالانسی، عدد اکسیداسیون منفی به الکترونگاتیوترین اتم و بقیه مثبت هستند.
- مجموع جبری حالت های اکسیداسیون عناصر در یک ترکیب صفر است.
- مجموع جبری حالت های اکسیداسیون عناصر یک یون چند اتمی برابر با بار روی یون است. ۱