مقیاس pH
اهداف یادگیری
- برای تعریف مقیاس pH به عنوان معیار اسیدیته یک محلول
- منشا و منطق استفاده از مقیاس pH را بگویید.
- همین استراتژی را برای نمایش انواع دیگر کمیت ها مانند p K a , p K b , p K w اعمال کنید .
یونیزاسیون خودکار آب
آب به دلیل ماهیت آمفوتریک آن (یعنی هم به عنوان اسید یا یک باز عمل می کند)، همیشه به همان شکل باقی نمی مانداچ۲Oاچ۲�مولکول ها. در واقع، دو مولکول آب واکنش نشان می دهند و یون های هیدرونیوم و هیدروکسید را تشکیل می دهند:
به این حالت خودیونیزاسیون آب نیز می گویند. غلظت ازاچ۳O+اچ۳�+وOاچ–�اچ-در آب خالص به دلیل نسبت استوکیومتری ۱:۱ معادله برابر هستند۱۱. مولاریته H ۳ O + و OH – در آب نیز هر دو هستند۱٫۰ ×۱۰– ۷م۱٫۰×۱۰-۷مدر ۲۵ درجه سانتیگراد. بنابراین، ثابت آب (کwک�) برای نشان دادن شرایط تعادلی برای خودیونیزاسیون آب ایجاد شده است. حاصل ضرب مولاریته هیدرونیوم و یون هیدروکسید همیشه است۱٫۰ ×۱۰– ۱۴۱٫۰×۱۰-۱۴(در دمای اتاق).
معادله۲۲همچنین برای تمام محلول های آبی اعمال می شود. با این حال،کwک�در دماهای مختلف تغییر می کند، که بر محدوده pH که در زیر بحث شده است تأثیر می گذارد.
اچ+اچ+واچ۳O+اچ۳�+اغلب به جای هم برای نشان دادن پروتون هیدراته استفاده می شود که معمولاً یون هیدرونیوم نامیده می شود .
معادله۱۱را نیز می توان به صورت نوشتاری کرد
همانطور که برای هر تعادلی انتظار می رود، واکنش می تواند به واکنش دهنده ها یا محصولات منتقل شود:
- اگر اسید (اچ+اچ+) به آب اضافه می شود، تعادل به سمت چپ و به سمت چپ تغییر می کندOاچ–�اچ-غلظت یون کاهش می یابد
- اگر پایه (Oاچ–�اچ-) به آب اضافه می شود، تعادل به چپ تغییر می کند واچ+اچ+غلظت کاهش می یابد
pH و pOH
زیرا ثابت آب، Kw است۱٫۰ ×۱۰– ۱۴۱٫۰×۱۰-۱۴(در دمای ۲۵ درجه سانتیگراد)،پکwپک�۱۴ است، ثابت آب محدوده مقیاس pH را تعیین می کند. برای درک اینکه pK w چیست، مهم است که ابتدا بفهمیم “p” در pOH و pH به چه معناست. جمع “p” منعکس کننده منفی لگاریتم است،– ورود به سیستم-ورود به سیستم. بنابراین، pH لگاریتم منفی مولاریته H است، pOH لگاریتم منفی مولاریته H است.اوه–اوه-، وپکwپک�لگاریتم منفی ثابت آب است:
در دمای اتاق،
بنابراین
با استفاده از خواص لگاریتم، معادله۸۸را می توان به صورت بازنویسی کرد
معادله همچنین نشان می دهد که هر واحد افزایشی در مقیاس با ضریب ده در غلظت کاهش می یابداچ+اچ+. ترکیب معادلات ترانسمیتر آنلاین pH ۴۴–۶۶و۸۸نتیجه این رابطه مهم است:
معادله۱۱۱۱فقط در دمای اتاق صحیح است زیرا تغییر دما تغییر خواهد کردکwک�.
مقیاس pH لگاریتمی است، به این معنی که افزایش یا کاهش یک عدد صحیح غلظت را ده برابر می کند. به عنوان مثال، pH 3 ده برابر اسیدی تر از pH 4 است. به همین ترتیب، pH 3 صد برابر اسیدی تر از pH 5 است. به طور مشابه pH 11 ده برابر اساسی تر از pH است. ۱۰٫

خواص مقیاس pH
از تعریف ساده pH در معادله۴۴، ویژگی های زیر را می توان شناسایی کرد:
- این مقیاس برای استفاده راحت است، زیرا برخی از عبارات عجیب و غریب مانند۱٫۲۳ ×۱۰– ۴۱٫۲۳×۱۰-۴به یک عدد ۳٫۹۱٫
- این مقیاس طیف بسیار وسیعی از[اچ+][اچ+]، از ۰٫۱ تا ۱۰ -۱۴ . چه زمانی[اچ+][اچ+]بالا است، ما معمولاً از مقدار pH استفاده نمی کنیم، بلکه فقط از مقدار pH استفاده می کنیم[اچ+][اچ+]. مثلاً وقتی[اچ+] = ۱٫۰[اچ+]=۱٫۰، pH = 0. ما به ندرت می گوییم PH 0 است، و به همین دلیل است که شما pH = 0 را یک عبارت عجیب و غریب در نظر می گیرید. pH = -0.30 معادل a است[اچ+][اچ+]۲٫۰ M. مقادیر pH منفی فقط برای تمرینات آکادمیک است. استفاده از غلظت ها به طور مستقیم حس بهتری را نسبت به مقیاس pH منتقل می کند.
- مقیاس pH تقسیم بین صفر و ۱ را در مقیاس خطی یا مقیاس فشرده به مقیاس بزرگ برای مقاصد مقایسه گسترش می دهد. در ریاضیات، شما یاد گرفتید که مقادیر بینهایت بین ۰ و ۱، یا بین ۰ تا ۰٫۱، یا بین ۰ تا ۰٫۰۱ یا بین ۰ و هر مقدار کوچک وجود دارد. استفاده از مقیاس log مطمئناً مقادیر کوچک بی نهایت را به مقادیر بی نهایت بزرگ تبدیل می کند.
- غیر خطی بودن مقیاس pH بر حسب[اچ+][اچ+]به راحتی با مشاهده مقادیر مربوط به pH بین ۰٫۱ و ۰٫۹ به شرح زیر نشان داده می شود:
| pH | ۰ | ۰٫۱ | ۰٫۲ | ۰٫۳ | ۰٫۴ | ۰٫۵ | ۰٫۶ | ۰٫۷ | ۰٫۸ | ۰٫۹ |
|---|---|---|---|---|---|---|---|---|---|---|
| [H + ] | ۱ | ۰٫۷۹ | ۰٫۶۳ | ۰٫۵۰ | ۰٫۴۰ | ۰٫۳۲ | ۰٫۲۵ | ۰٫۲۰ | ۰٫۱۶ | ۰٫۱۳ |
- از آنجا که ورود منفی از[اچ+][اچ+]در مقیاس pH استفاده می شود، مقیاس pH معمولا دارای مقادیر مثبت است. علاوه بر این، هرچه PH بزرگتر باشد، کوچکتر است[اچ+][اچ+].
محدوده موثر مقیاس pH
معمولاً استدلال می شود که مقیاس pH از ۰-۱۴ یا شاید ۱-۱۴ متغیر است، اما هیچ کدام صحیح نیست. محدوده pH دارای کران بالا و پایین نیست، زیرا همانطور که در بالا تعریف شد، pH نشان دهنده غلظت H + است . به عنوان مثال، در pH صفر، غلظت یون هیدرونیوم یک مولر است، در حالی که در pH 14 غلظت یون هیدروکسید یک مولر است. به طور معمول غلظت H + در آب در اکثر محلول ها بین محدوده ۱ M (pH=0) و ۱۰-۱۴ M (pH=14) قرار دارد . از این رو، محدوده ۰ تا ۱۴ «پایههای کتاب» معقول (اما نه مطلق) را برای مقیاس فراهم میکند. در آب می توان تا حدودی زیر صفر و تا حدودی بالای ۱۴ رفت، زیرا غلظت یون های هیدرونیوم یا یون های هیدروکسید می تواند از یک مولر بیشتر شود. شکل۱۱مقیاس pH را با محلول های رایج و جایی که آنها در مقیاس هستند نشان می دهد.
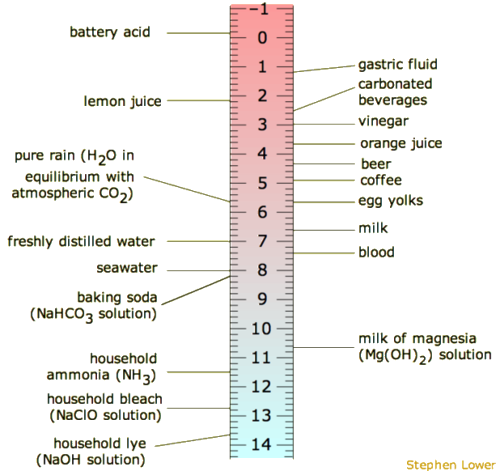
تفسیر سریع
- اگر PH بالاتر از ۷ باشد، محلول پایه است. pOH را باید در منظر OH – به جای H + نگاه کرد . هر گاه مقدار pOH کمتر از ۷ باشد، آن را پایه در نظر می گیرند. و بنابراین OH – بیش از H + در محلول وجود دارد .
- در pH 7، ماده یا محلول خنثی است و به این معنی است که غلظت یون H + و OH – یکسان است.
- اگر PH کمتر از ۷ باشد محلول اسیدی است. در محلول اسیدی H + بیشتر از OH – وجود دارد .
- مقیاس pH حد بالایی و پایینی ندارد .
مثال۱۱
اگر غلظت ازنa O Hنآ�اچدر یک راه حل است۲٫۵ ×۱۰– ۴م۲٫۵×۱۰-۴م، غلظت چیستاچ۳O+اچ۳�+?
راه حل
ما می توانیم دمای اتاق را فرض کنیم، بنابراین
برای یافتن غلظت H ۳ O + ، [H ۳ O + ] را حل کنید .
مثال۲۲
- PH محلول ۰۰۲/۰ مولار HCl را بیابید.
- PH محلول ۰۰۰۰۵/۰ مولار NaOH را بیابید.
راه حل
- معادله pH -log [H+] است.
- معادله pOH -log [OH – ] است.
و
سپس
مثال۳۳: خاک
اگر خاک مرطوب دارای pH 7.84 باشد، غلظت H + محلول خاک چقدر است؟
راه حل
اشاره
۷٫۸۴- را در ماشین حساب خود قرار دهید و آنتی لاگ (اغلب log معکوس یا ۱۰ x ) = ۱٫۴۵ x 10 -۸ M را بردارید.

تعریف صحیح pH
مقیاس pH در ابتدا توسط بیوشیمیدان دانمارکی SPL Sørenson در سال ۱۹۰۹ با استفاده از نماد p H معرفی شد . حرف p از کلمه آلمانی potenz به معنای قدرت یا توان، در این مورد، ۱۰ گرفته شده است. در سال ۱۹۰۹، SPL Sørenson مقاله ای را در Biochem Z منتشر کرد که در آن تأثیر یون های H + بر فعالیت آنزیم ها را مورد بحث قرار داد. در این مقاله، او اصطلاح pH ( به ظاهر به معنای pondus hydrogenii در لاتین) را برای توصیف این اثر اختراع کرد و آن را به عنوان– ورود به سیستم[اچ+]-ورود به سیستم[اچ+]. در سال ۱۹۲۴، سورنسون متوجه شد که pH یک محلول تابعی از “فعالیت” یون H + است نه غلظت. بنابراین، او مقاله دوم در این زمینه منتشر کرد. تعریف بهتری خواهد بود
جایی کهآ {اچ+}آ{اچ+}نشان دهنده فعالیت (یک غلظت موثر) یون های H + است . فعالیت یک یون تابعی از متغیرهای زیادی است که غلظت آنها یکی است.
- غلظت با استفاده از براکت های مربع به اختصار، به عنوان مثال،[اچ۳O+][اچ۳�+]غلظت یون هیدرونیوم در محلول است.
- فعالیت با استفاده از “a” با براکت های فرفری به اختصار، به عنوان مثال،آ {اچ۳O+}آ{اچ۳�+} ترانسمیتر آنلاین pH فعالیت یون هیدرونیوم در محلول است
با
- آرآرثابت گاز ایده آل است،
- افافثابت فارادی است و
- تیتیدمای مطلق است (بر حسب K)
فعالیت یون H + برای محلول های استاندارد مورد استفاده تا حد امکان دقیق تعیین می شود. هویت این محلول ها از مرجعی به مرجع دیگر متفاوت است، اما همگی مقادیر یکسانی از pH را تا ۰٫۰۰۵ ± واحد pH می دهند. تعریف تاریخی pH برای محلولهایی که بسیار رقیق و خالص هستند، یونهای H + تحت تأثیر چیزی جز مولکولهای حلال (معمولاً آب) نیستند.
هنگام اندازه گیری pH، [H + ] بر حسب واحد مول H + در هر لیتر محلول است. این یک تعریف نسبتا دقیق در غلظت های پایین (حد رقیق) H + است . در غلظتهای بسیار بالا (مثلاً اسید کلریدریک ۱۰ مولار یا هیدروکسید سدیم) بخش قابلتوجهی از یونها به جفتهای خنثی مانند H + Cl- مرتبط میشوند ، بنابراین غلظت یونهای «در دسترس» به مقدار کمتری کاهش مییابد. غلظت موثر را می نامیم . این غلظت موثر H + و OH است که pH و pOH را تعیین می کند. مقیاس pH همانطور که در بالا نشان داده شده است گاهی اوقات “مقیاس pH غلظت” نامیده می شود در مقابل “مقیاس pH ترمودینامیکی”. تفاوت اصلی بین هر دو مقیاس این است که در مقیاس pH ترمودینامیکی فرد به غلظت H + علاقه ندارد ، بلکه به فعالیت H + علاقه دارد . چیزی که فرد در محلول اندازه گیری می کند فقط فعالیت است، نه تمرکز. بنابراین این مقیاس pH ترمودینامیکی است که محلول های واقعی را توصیف می کند، نه غلظت.
برای محلول هایی که غلظت یون در آنها از ۰٫۱ M تجاوز نمی کند، فرمول pH = –log [H + ] و pOH = –log[OH – ] به طور کلی قابل اعتماد هستند، اما انتظار نداشته باشید ترانسمیتر آنلاین pH محلول ۱۰٫۰ M از یک اسید قوی باشد. PH دقیقاً ۱٫۰۰- است! با این حال، این تعریف تنها یک تقریب (البته در اکثر شرایط بسیار خوب) از تعریف مناسب pH است که به فعالیت یون هیدروژن بستگی دارد:
فعالیت معیاری از “غلظت موثر” یک ماده است که اغلب از طریق یک ضریب فعالیت با غلظت واقعی مرتبط است.γ�:
محاسبه ضریب فعالیت نیاز به تئوری های دقیقی در مورد نحوه تعامل گونه های باردار در محلول در غلظت های بالا دارد (به عنوان مثال، نظریه Debye -Hückel ). در اکثر محلول ها pH با -log[H + ] در اولین نقطه اعشار متفاوت است. جدول زیر مقادیر PH تعیین شده تجربی را برای یک سری محلول HCl با غلظت فزاینده در دمای ۲۵ درجه سانتیگراد نشان می دهد.
| غلظت مولی ازاچسیلاچسیل | pH به عنوان غلظت تعریف می شود | PH به صورت تجربی تعیین شده است | انحراف نسبی |
|---|---|---|---|
| ۰٫۰۰۰۵۰ | ۳٫۳۰ | ۳٫۳۱ | ۰٫۳٪ |
| ۰٫۰۱۰۰ | ۲ | ۲٫۰۴ | ۱٫۹٪ |
| ۰٫۱۰۰ | ۱ | ۱٫۱۰ | ۹% |
| ۰٫۴۰ | ۰٫۳۹ | ۰٫۵۲ | ۲۵% |
| ۷٫۶ | -۰٫۸۸ | -۱٫۸۵ | ۵۲% |
در حالی که مقیاس pH به طور رسمی فعالیت یونهای هیدروژن را در یک ماده یا محلول اندازهگیری میکند، معمولاً به عنوان غلظت یونهای هیدروژن تقریبی میشود. این تقریب فقط در غلظت های پایین قابل استفاده است.
سیستم های زندگی
مولکول هایی که موجودات زنده را تشکیل می دهند ترانسمیتر آنلاین pH یا توسط موجودات زنده تولید می شوند، معمولاً در محدوده pH باریک (نزدیک به خنثی) و محدوده دمایی باریک (دمای بدن) عمل می کنند. بسیاری از محلول های بیولوژیکی، مانند خون، pH تقریبا خنثی دارند. pH بر ساختار و عملکرد بسیاری از آنزیم ها (کاتالیزورهای پروتئینی) در سیستم های زنده تأثیر می گذارد. بسیاری از این آنزیم ها محدوده باریکی از فعالیت pH دارند. PH سلولی آنقدر مهم است که اگر فرد اسیدی شود (افزایش اسیدیته در خون) ممکن است در عرض چند ساعت مرگ رخ دهد. همانطور که می بینید pH برای زندگی، بیوشیمی و واکنش های شیمیایی مهم حیاتی است. مثالهای متداول از اینکه چگونه pH نقش بسیار مهمی در زندگی روزمره ما بازی میکند در زیر آورده شده است:
- آب در استخر شنا با بررسی PH آن حفظ می شود. اگر آب خیلی اسیدی یا بازی شود، می توان مواد شیمیایی اسیدی یا بازی اضافه کرد.
- هر زمان که دچار دل درد می شویم، اسید بیشتری در معده جمع می شود و باعث درد می شود. برای خنثی کردن اسید اضافی معده باید قرص های آنتی اسید (یک پایه) مصرف کنیم.
- pH خون کمی پایه است. نوسان در pH خون می تواند آسیب جدی به اندام های حیاتی بدن وارد کند.
- برخی بیماری ها تنها با بررسی PH خون و ادرار تشخیص داده می شوند.
- برخی از محصولات در محدوده pH خاصی رشد بهتری دارند.
- آنزیم ها در pH خاصی در بدن ما فعال می شوند.
| محفظه | pH |
|---|---|
| اسید معده | ۱ |
| لیزوزوم ها | ۴٫۵ |
| گرانول سلول های کرومافین | ۵٫۵ |
| پوست انسان | ۵٫۵ |
| ادرار | ۶ |
| H 2 O خنثی در ۳۷ درجه سانتیگراد | ۶٫۸۱ |
| سیتوزول | ۷٫۲ |
| مایع مغزی نخاعی | ۷٫۳ |
| خون | ۷٫۴۳-۷٫۴۵ |
| ماتریکس میتوکندری | ۷٫۵ |
| ترشحات پانکراس | ۸٫۱ |
چالش ها و مسائل ترانسمیتر آنلاین pH
- در یک راه حل از۲٫۴ ×۱۰– ۳م۲٫۴×۱۰-۳ماز HI، غلظت آن را پیدا کنیدOاچ–�اچ-.
- pH محلولی که ۰۰۳۵/۰ مولار هیدروکلراید است را تعیین کنید.
- [H ۳ O + ] محلولی با pH = 5.65 را تعیین کنید
- اگر pOH NH ۳ ، آمونیاک، در آب ۴٫۷۴ باشد. pH چیست؟
- پپسین، یک آنزیم گوارشی در معده ما، دارای pH 1.5 است. غلظت OH – در معده را پیدا کنید.
راه حل های ترانسمیتر آنلاین pH
- برای یافتن [OH – ] از تفکیک معادله آب استفاده می کنیم .
K w = [H ۳ O + ][OH – ] = ۱٫۰ X 10 -۱۴
حل برای [OH – ]
[OH – ] = (۱٫۰ X 10 -۱۴ )/ [H ۳ O + ]
مولاریته HI را وصل کنید و برای OH – حل کنید .
[OH – ] = (۱٫۰ X 10 -۱۴ )/ [۲٫۴ X 10 -۳ ] = ۴٫۱۷ X 10 -۱۲ M. - pH = -log[H ۳ O + ]
مولاریته HCl را وارد کنید و pH را حل کنید.
pH = -log[0.0035] = 2.46 - pH = -log[H ۳ O + ]
pH را وصل کنید و برای [H3O+]
۵٫۶۵ = -log[H ۳ O + ] حل کنید
علامت منفی را به pH منتقل کنید. -۵٫۶۵ = log[H ۳ O + ]
۱۰ -۵٫۶۵ = ۱۰ log [H ۳ O+] = ۲٫۲۴ X 10 -۶ M - pH + pOH = 14
برای pH حل کنید.
۱۴ – pOH = pH
۱۴ – ۴٫۷۴ = pH = 9.26 - راه های مختلفی برای رفع این مشکل وجود دارد.
پاسخ ۱٫
pH + pOH = 14
برای pOH حل کنید.
pOH = 14 – pH
pOH = 14 – 1.5 = 12.5
هنگامی که pOH حل شد، غلظت را با استفاده از log حل کنید.
pOH = -log[OH – ]
۱۲٫۵ = -log[OH – ]
-۱۲٫۵ = log[OH – ]
۱۰ -۱۲٫۵ = ۱۰ log [OH-] = ۳٫۱۶ X 10 -۱۳ M.پاسخ ۲٫
pH = -log[ H + ]
pH را وصل کنید و مولاریته H+ پپسین را حل کنید.
۱٫۵ = -log[H + ]
-۱٫۵ = log[H + ]
۱۰ -۱٫۵ = ۱۰ لیتر og [H+] = [H + ]= ۰٫۰۳۲
از غلظت H + برای حل غلظت OH – استفاده کنید .
[H + ][OH – ] = ۱٫۰ X 10 -۱۴ [H +
] را وصل کنید و [OH – ] را حل کنید.
[OH – ] = (۱٫۰ X 10 -۱۴ )/[H ۳ O + ]
[OH – ] = (۱٫۰ X 10 -۱۴ )/(۰٫۰۳۲) = ۳٫۱۲۵ X 10 -۱۴ M
منابع ترانسمیتر آنلاین pH
- پتروچی و همکاران “خود یونیزاسیون آب و مقیاس pH.” شیمی عمومی: اصول و کاربردهای مدرن . ویرایش هفتم رودخانه زین بالایی: پیرسون پرنتیس هال، ۲۰۰۷٫ ۶۶۹-۷۱٫
- Segel, Irwin H. “اسید و باز.” محاسبات بیوشیمیایی ویرایش دوم وایلی: کتاب بی کی، ۱۹۷۶٫ ۱۲٫
- کریستوفر جی مک کارتی و اد ویتز، مجله آموزش شیمی، ۸۳ (۵)، ۷۵۲ (۲۰۰۶)
فرستنده ترانسمیتر چیست و چگونه برای صنایع فرآیندی مفید است
وظایف یک فرستنده ترانسمیتر چیست؟
وظیفه اصلی یک فرستنده ترانسمیتر تغییر یا تبدیل مقادیر از یک حسگر به سیگنال است که سپس به یک کنترل کننده منتقل می شود. فرستنده ترانسمیتر برای انتقال سیگنال ها از مکان های دور به کنترل کننده استفاده می شود زیرا بیشتر ابزارها از کنترل کننده دور خواهند بود بنابراین انتقال سیگنال با استفاده از فرستنده ترانسمیتر امکان پذیر است.
- تفاوت بین مبدل و فرستنده ترانسمیتر
- فرستنده ترانسمیتر های هوشمند
- فرستنده ترانسمیتر معمولی و هوشمند
- ورودی های ۴-۲۰ میلی آمپر از اندازه گیری فرستنده ترانسمیتر
- فرستنده ترانسمیتر سطح
- ترانسمیتر سطح پنوماتیک
- ترانسمیترها در صنایع فرآیندی
- حلقه جریان فرستنده ترانسمیتر ۴ سیم و ۲ سیم
- کالیبراسیون فرستنده ترانسمیتر های هوشمند
- فرستنده ترانسمیتر های جریان
انواع فرستنده ترانسمیتر ها کدامند؟
- ترانسمیترهای فشار
- فرستنده ترانسمیتر های جریان
- فرستنده ترانسمیتر های دما
- فرستنده ترانسمیتر های سطح
- آنالایزرهای اکسیژن
انواع فرستنده ترانسمیتر صنعتی
فرستنده ترانسمیتر های آنالوگ
فرستنده ترانسمیتر هایی که برای کاربردهای صنعتی استفاده می شوند اطلاعات اندازه گیری شده را با استفاده از سیگنال جریان آنالوگ منتقل می کنند و محدوده جریان ۴-۲۰ میلی آمپر خواهد بود و جریان به مقدار اندازه گیری شده بستگی دارد. در این نوع فرستنده ترانسمیتر اتصال از فرستنده ترانسمیتر به بقیه قسمت های سیستم با استفاده از دو سیم انجام می شود و از این دو سیم برای انتقال برق و سیگنال استفاده می شود.
فرستنده ترانسمیتر هوشمند
شبیه فرستنده ترانسمیتر آنالوگ است، از اتصال دو سیم مشابهی استفاده می کند که در فرستنده ترانسمیتر های آنالوگ دیده می شود، اما تفاوت آن در این است که سیگنال از سنسور دیجیتالی می شود و سپس سیگنال با کمک یک ریزپردازنده و همچنین ارسال می شود. از مبدل دیجیتال به آنالوگ استفاده می کند تا بتواند سیگنال جریان آنالوگ ایجاد کند.
فرستنده ترانسمیتر های هوشمند
این نوع فرستنده ترانسمیتر ارتباطات دو طرفه دیجیتال را انجام می دهد و این فرستنده ترانسمیتر دارای رابط ارتباطی صنعتی مانند Fieldbus می باشد. این امر مزایای زیادی برای انتقال سیگنال دارد، بنابراین یک فرستنده ترانسمیتر هوشمند را می توان فرستنده ترانسمیتر ای دانست که دارای ارتباطات دو طرفه دیجیتال و پردازش سیگنال دیجیتال است.
فرستنده ترانسمیتر چگونه کار می کند و انواع سیگنال های مورد استفاده در فرستنده ترانسمیتر چیست؟
یک فرستنده ترانسمیتر مقادیر اندازه گیری را از ابزار دریافت می کند و این مقادیر تبدیل می شوند که به راحتی به کنترل کننده منتقل می شوند. بنابراین مقادیر به سیگنال تبدیل می شوند. فرستنده ترانسمیتر به عنوان یک مبدل ثانویه شناخته می شود، می تواند سیگنال فیزیکی را تبدیل کند و همچنین می تواند اطلاعات را به فاصله خوبی نیز منتقل کند. بیشتر در صنعت فرآیند، از سه نوع سیگنال برای انتقال مقدار اندازه گیری شده ابزار به سیستم کنترل استفاده می شود که عبارتند از سیگنال پنوماتیک، سیگنال آنالوگ و سیگنال دیجیتال.
فاکتورهای مورد نیاز برای یک فرستنده ترانسمیتر چیست؟ چگونه یک فرستنده ترانسمیتر را انتخاب کنیم؟
- باید قدرت خوبی داشته باشه
- باید کارآمد باشد
- باید دقت خوبی داشته باشد
- ثبات عامل مهمی است
- شرایط اتصال کوتاه نیز باید در نظر گرفته شود، اگر خروجی کوتاه باشد، هیچ آسیبی به فرستنده ترانسمیتر نمیرسد.
- اثر موقعیت نصب نیز باید در نظر گرفته شود
- باید با توجه به سرویس انتخاب شود
- باید با توجه به محدوده انتخاب شود
- منبع تغذیه باید در نظر گرفته شود
- باید با توجه به مکان انتخاب شود
- هنگام انتخاب فرستنده ترانسمیتر باید دما و فشار را در نظر گرفت
- باید با توجه به نیازهای تعمیر و نگهداری انتخاب شود
هنگام انتخاب فرستنده ترانسمیتر باید پارامتر فرآیند را در نظر بگیریم همچنین باید نوع اندازه گیری را به گونه ای در نظر بگیریم ترانسمیتر آنلاین pH که گویی مستقیم یا غیر مستقیم است. نوع خروجی باید در هنگام انتخاب آن در نظر گرفته شود و نصب آن نیز باید در نظر گرفته شود. یک فرستنده ترانسمیتر باید با توجه به نوع سیگنال ارسالی انتخاب شود و همچنین باید امکانات دریافت را در نظر بگیریم.
چرا به فرستنده ترانسمیتر نیاز داریم؟
- سیگنال هایی که توسط ابزار تولید می شود باید به سیستم کنترل منتقل شود و این کار با استفاده از فرستنده ترانسمیتر انجام می شود.
- سیستم دریافت یا سیستم کنترل فقط یک سیگنال استاندارد دریافت می کند، ترانسمیتر آنلاین pH بنابراین برای این کار به فرستنده ترانسمیتر نیاز داریم
- انتقال سیگنال از راه دور توسط این دستگاه انجام می شود
- ممکن است تداخلی برای خروجی سنسور وجود داشته باشد
مزایای فرستنده ترانسمیتر های هوشمند چیست؟
- اندازه آن کوچک است
- برد خوبی داره
- قابلیت اطمینان خوب
- استفاده آسان و هزینه کمتر
- دارای ویژگی هایی مانند خود تصحیح و نمایش خودکار است
- دارای قابلیت ذخیره سازی اطلاعات الکترونیکی است
- می تواند خود تشخیصی را انجام دهد و کالیبراسیون از راه دور نیز امکان پذیر است
کاربرد فرستنده ترانسمیتر ها چیست؟
- در صنعت پتروشیمی استفاده می شود
- ترانسمیترها در صنعت خمیر و کاغذ استفاده می شوند
- صنعت کود
- همچنین در کارخانه مواد شیمیایی و قند استفاده می شود
بنابراین می توان گفت که فرستنده ترانسمیتر یک وسیله اجتناب ناپذیر برای اکثر کاربردهای صنعتی است که برای کاربردهای اتوماسیون نیز استفاده می شود.